日期:2025-07-18 08:24:27

2025年7月16日,由中山大学肿瘤防治中心徐瑞华教授担任Leading PI,中山大学肿瘤防治中心邱妙珍教授、阮丹云教授担任助理研究者(Sub-I)的一项Ⅰ期临床研究(注册号:NCT04877717)正式发表于国际知名期刊Nature Medicine(IF:50)[1]。该研究评估了新型抗体偶联药物(ADC)SHR-A1904用于Claudin 18.2(CLDN18.2)阳性胃癌/胃食管结合部腺癌(GC/GEJC)患者的安全性和疗效,结果显示SHR-A1904具有可管理的安全性和令人鼓舞的抗肿瘤活性,临床潜力可期。在此,《中国医学论坛报》特邀徐瑞华教授和阮丹云教授接受访谈,分享研究情况,剖析研究意义,展望领域发展。
论坛报
祝贺您们的研究正式见刊Nature Medicine,请您介绍一下这项研究的开展背景及研究设计。
阮丹云教授:CLDN18.2是一种紧密连接蛋白,正常情况下主要存在于胃黏膜上皮细胞中。在恶性肿瘤转化过程中,其表位暴露于肿瘤细胞表面,且在GC/GEJC中呈现较高的阳性表达率,使其成为一个极具前景的治疗靶点。目前针对该靶点的不同类型药物正如火如荼地探索中,SHR-A1904是恒瑞医药(600276)自主研发的靶向CLDN18.2的ADC,由针对CLDN18.2的IgG1单克隆抗体、可切割的连接子和拓扑异构酶I抑制剂组成。这种设计可将细胞毒性药物直接传递到表达CLDN18.2的肿瘤细胞,从而减少对正常细胞的损害。因此,我们开展了这项SHR-A1904的首次人体I期临床研究,系统性地评估SHR-A1904在经治的CLDN18.2阳性晚期实体瘤患者中的安全性、耐受性、药代动力学特征以及初步的抗肿瘤活性,为后续临床开发确定关键剂量参数。
研究在中国19个中心进行,纳入18~75岁CLDN18.2阳性晚期/转移性实体瘤患者,这些患者均既往治疗失败或缺乏标准治疗,并且创新性地允许既往接受过抗CLDN18.2靶向治疗的患者入组,这在当时同类研究中考虑较为前瞻,可真实地反映临床实践中的患者情况,也为评估SHR-A1904在此类患者中的治疗潜力提供了依据。CLDN18.2阳性状态定义为≥1%的肿瘤细胞存在任何强度的膜染色。
设计采用严谨的三阶段(剂量递增、药代动力学扩展、疗效扩展)模式。在剂量递增阶段,采用i3+3设计,起始剂量为0.6 mg/kg,逐步递增至8.0 mg/kg,每三周给药一次。基于对剂量递增阶段获得数据的全面审查,安全监测委员会(SMC)选择两到三个剂量进行药代动力学扩展,招募患者接受推荐剂量治疗。在疗效扩展阶段,特定适应症的队列(包括GC/GEJC)接受最佳剂量的药物治疗。主要研究终点包括安全性、剂量限制毒性(DLT)、最大耐受剂量(MTD)和推荐的Ⅱ期剂量(RP2D)。次要终点包括药代动力学特征、免疫原性以及疗效指标。
论坛报
SHR-A1904 I期研究展现出的核心安全性特征和抗肿瘤活性数据如何?
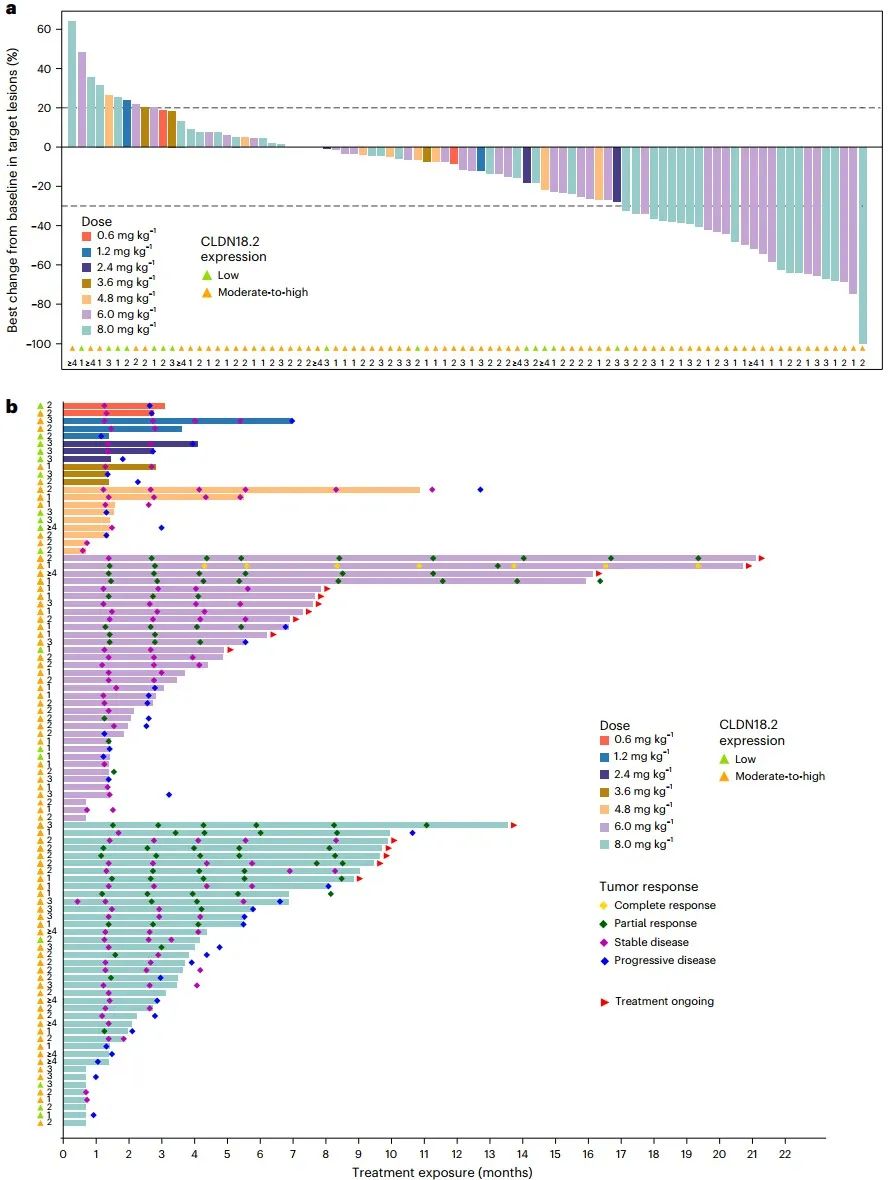
阮丹云教授:本次Nature Medicine上发表的是GC/GEJC队列剂量递增、药代动力学扩展和疗效扩展阶段的结果,包括既往接受或未接受过CLDN18.2靶向治疗的患者。
在剂量递增阶段,我们观察到了DLT:在4.8 mg/kg剂量组有2例患者分别发生了3级发热性中性粒细胞减少症和3级高胆红素血症;在6.0 mg/kg剂量组有1例患者发生了3级胃黏膜病变。基于此,研究未达到预设的MTD,并选择了6.0 mg/kg和8.0 mg/kg进行药代动力学和疗效扩展研究。
最终结果证实了SHR-A1904具有可管理的安全性特征。在纳入最终分析的95例患者中,59例(62.1%)患者报告了≥3级药物治疗相关不良事件(TRAEs),未报告治疗相关死亡。所有患者(100%)均发生了治疗期间不良事件(TEAEs),最常见的是贫血(75.8%)、恶心(67.4%)、低白蛋白血症(64.2%)和白细胞计数减少(58.9%)。这些常见不良事件大多可通过支持治疗、剂量调整以及预防性措施进行有效管理。
在抗肿瘤活性方面,SHR-A1904展现出令人鼓舞的疗效信号。在疗效可评估患者中,6.0 mg/kg剂量组确认的客观缓解率(ORR)为24.2%(95% CI, 11.1-42.3);8.0 mg/kg剂量组为25.0%(95% CI, 12.1-42.2)。除了缓解率,无进展生存期(PFS)的数据也提供了重要的疗效信息:在6.0 mg/kg剂量组,中位PFS为5.6个月(95% CI, 3.0–6.9);在8.0 mg/kg剂量组,中位PFS为5.8个月(95% CI, 3.0–8.6)。对于后线治疗的晚期GC/GEJC患者而言,这些疗效数据具有重要的临床意义,提示SHR-A1904能够带来疾病稳定控制,延缓肿瘤进展。
图 SHR-A1904的抗肿瘤作用
论坛报
基于I期研究结果,您如何评价SHR-A1904在CLDN18.2阳性晚期GC/GEJC治疗中的潜在临床价值及其对后续研发的指导意义?
阮丹云教授:首先,SHR-A1904作为一款靶向CLDN18.2的国产原研ADC,其安全性特征总体可控,主要毒性可预测、可管理,未发现超出预期的严重安全隐患,这为其后续的临床开发和应用奠定了基础,特别是考虑到后续研究将探索其与化疗或免疫治疗的联合方案。第二,在标准治疗失败(甚至部分患者接受过同类靶向治疗)的晚期GC/GEJC患者中,SHR-A1904单药治疗即显示出具有临床意义的抗肿瘤活性,其确认的ORR和稳定的中位PFS为这类预后不佳的患者群体提供了一个有前景的新治疗选择。第三,6.0 mg/kg和8.0 mg/kg两个剂量组均显示出相当的疗效水平(ORR和PFS相近),这为后续Ⅱ/Ⅲ期研究推荐剂量的选择提供了重要的参考依据。
综上所述,这项I期研究的积极结果,有力地支持了SHR-A1904在CLDN18.2阳性GC/GEJC中进一步开展更大规模的Ⅱ/Ⅲ期临床研究,以确证其疗效并争取惠及更多患者。
论坛报
请您谈谈CLDN18.2靶点在消化道肿瘤治疗领域,特别是胃癌中,具有怎样的独特生物学价值和临床应用前景?
徐瑞华教授:中国是胃癌高发大国,全国胃癌的年发病人数超过35万,位列所有恶性肿瘤第5位;死亡人数超过26万,位列恶性肿瘤第3位,且多数患者确诊时已处于中晚期,是严重威胁我国居民健康的疾病[2-4]。近年来,免疫及靶向等精准疗法为肿瘤治疗带来巨大的进步,但胃癌的优势人群占比偏低——dMMR、PD-L1 CPS≥1及HER2的阳性率分别约为5%~8%、50%~65%、10%~15%[5-9]。面对该困局,开发针对广谱靶点的新型疗法是当务之急。
CLDN18.2的独特生物学特性使其成为破局关键。其一,CLDN18.2在正常组织中特异性表达于胃黏膜上皮,而在胃癌中阳性率高达40%~80%[10,11],胰腺癌、胆管癌等消化道肿瘤中也普遍存在异位高表达。其二,肿瘤细胞极性紊乱导致CLDN18.2表位暴露,使其成为抗体药物的理想靶标。随着2024年底首款CLDN18.2单抗类药物的上市,CLDN18.2已从“潜力靶点”迈向“临床实践”,但患者治疗仍存较大空白,亟需更多元、更可及的治疗策略。
如本研究聚焦国产原研ADC药物SHR-A1904,正是基于对晚期GC/GEJC患者未满足临床需求的深刻洞察,以及靶向CLDN18.2这一新兴靶点的巨大潜力。
论坛报
近年来胃癌领域靶向治疗药物与治疗方案不断推陈出新,您认为当前胃癌靶向治疗面临的最主要挑战是什么?您有怎样的期待?
徐瑞华教授:近年来,胃癌靶向治疗领域虽取得显著进展,但仍面临诸多关键挑战。首先就是前面提到的靶点覆盖人群较局限,导致大量患者无法从现有靶向药物或PD-1/PD-L1抑制剂中获益。尤其在中国,晚期胃癌患者基数庞大,且确诊时多已丧失手术机会,亟需开发更丰富的创新药物。值得期待的是,CLDN18.2、FGFR2b等靶点药物正不断涌现,包括单克隆抗体、双特异性抗体、ADC和嵌合抗原受体T细胞免疫疗法等。随着首款CLDN18.2单抗上市,靶向治疗格局已迎来革新。期待SHR-A1904等潜力药物能够在临床试验中取得优异成果,为晚期胃癌患者带来更多有效的治疗选择。
第二,肿瘤异质性与耐药机制仍是临床实践的瓶颈。胃癌的高度异质性导致靶向治疗响应差异显著,部分患者初始疗效良好,却因继发耐药而疾病进展。未来需深入探索不同药物形式的优化组合与序贯策略,以最大化临床获益。目前非常多的联合策略(如靶向+免疫、靶向+化疗)研究正在开展中,期待突破耐药桎梏,并平衡疗效与安全性,为患者带来更长生存获益及良好的生活质量。
最后,提升药物可及性与个体化治疗精准度是可持续发展的核心。一方面,需加速国产原研创新药研发,降低治疗成本;另一方面,应整合多组学技术深化分子分型,建立预测性生物标志物体系,实现“精准用药”。胃癌治疗领域繁花初现,相信在不远的未来,精准诊疗之路将硕果累累,中国胃癌患者将迎来更美好的未来。
专家介绍
徐瑞华 教授
中国医学科学院学术咨询委员会学部委员
中山大学肿瘤防治中心主任、医院院长、研究所所长
教授、博士生导师、华南恶性肿瘤防治全国重点实验室主任
中国临床肿瘤学会第四届理事长
中国抗癌协会副理事长
中国抗癌协会肿瘤内科学专业委员会主任委员
中国抗癌协会靶向治疗专委会首届主任委员
中国临床肿瘤学会第二届肠癌专委会主任委员
中国临床肿瘤学会胃癌专委会首届主任委员
以最后通讯作者在NEJM、JAMA(2)、BMJ、Cell、Nature Medicine(5)、Nature Materials、Lancet Oncology(2)、Cancer Cell(3)、Annals of Oncology (2)等发表210余篇论文,其中IF>20分论文62篇,成果被写入85 部国际指南,连续3年入选科睿唯安(Clarivate)全球高被引科学家,连续7年入选中国高被引学者榜单,H指数92。
以第一完成人获得国家科技进步二等奖2项,中华医学科技奖、教育部科技奖及广东省科技奖等省部级一等奖共7项。获得第三届全国创新争先奖、何梁何利基金科学与技术奖、谈家桢临床医学奖、吴阶平医学创新奖以及CSCO年度成就奖。入选国家百千万人才工程、全国先进工作者、国务院特殊津贴专家、南粤百杰人才培养工程、国家卫生计生突出贡献中青年专家等人才项目。
邱妙珍 教授
中山大学肿瘤防治中心内科教授、主任医师、主诊教授、华南恶性肿瘤防治全国重点实验室PI、博士生导师。
美国约翰霍普金斯大学博士后。
国家高层次青年人才,广东省自然科学杰出青年基金获得者,入选2024全球前2%顶尖科学家“年度科学影响力排行榜”,人民好医生(胃癌领域)金山茶花.杰出贡献奖,获得ESMO Merit Award。
荣获国家科技进步二等奖和省部级科技进步一等奖等奖励5项,主持科技重大专项子课题、国自然面上等科研基金10余项,在BMJ、Nature Medicine、JAMA Oncol、Signal Transduct Target Ther等杂志发表第一/通讯作者SCI论文80余篇,H-index 46。CSCO胃癌专家委员会委员、CSCO胃癌指南撰写成员。主攻消化道肿瘤的精准治疗和耐药机制研究。
阮丹云 教授
中山大学肿瘤防治中心临床研究部一期病房副主任医师、医学博士、硕士生导师
中华医学会创新药物治疗学组委员会委员
中国医药教育协会肿瘤药物临床研究专委会委员
广东省抗癌协会肿瘤内科学专委会常务委员/秘书
广东省抗癌协会大肠癌专业委员会委员
广东省抗癌协会肿瘤靶向治疗专委会委员
广东省药学会肿瘤免疫治疗专家委员会委员
GDCACA肿瘤代谢专委会委员
主要研究方向为抗肿瘤新药临床试验与转化研究,消化道肿瘤个体化治疗。
参考文献:
1. Ruan DY, Wu HX, Luo SX, et al. The antibody–drug conjugate SHR-A1904 for targeting CLDN18.2 in advanced gastric or gastroesophageal junction cancer: a phase 1 trial. Nat Med (2025). https://doi.org/10.1038/s41591-025-03781-w
2. 王裕新,潘凯枫,李文庆.2022全球癌症统计报告解读[J/CD].肿瘤综合治疗电子杂志,2024,10(3):1-16.
3. 郑荣寿,陈茹,韩冰峰,等.2022年中国恶性肿瘤流行情况分析[J].中华肿瘤杂志,2024,46(3):221-231.
4. KUS T, KOSE F, AKTAS G, et al. Prediction of peritoneal recurrence in patients with gastric cancer: a multicenter study[J]. J Gastrointest Cancer, 2021, 52(2):634-642.
5. Zhao L, Fu Y, Niu P, et al. Perioperative Chemotherapy Could Not Improve the Prognosis of Gastric Cancer Patients With Mismatch Repair Deficiency: A Multicenter, Real-World Study[J]. Oncologist. 2023;28(10):e891-e901.
6. Chen X, Zhang H, Wang M, et al. Relationship Between Programmed Death Ligand 1 Expression and Other Clinicopathological Features in a Large Cohort of Gastric Cancer Patients[J]. Front Immunol. 2022;13:783695.
7. Oh D Y, Yeo W, Chen J S, et al. 182P Real-world treatment (Tx) patterns in patients (pts) with HER2-positive locally advanced or metastatic gastric or gastroesophageal junction adenocarcinoma (HER2+ aGC/GEJC) in East Asia (HER2+ GASTA)[J]. Annals of Oncology, 2024, 35: S1475.
8. Sawaki A, Ohashi Y, Omuro Y, et al. Efficacy of trastuzumab in Japanese patients with HER2-positive advanced gastric or gastroesophageal junction cancer: a subgroup analysis of the Trastuzumab for Gastric Cancer (ToGA) study[J]. Gastric Cancer, 2012, 15: 313-322.
9. Kim W H, Gomez-Izquierdo L, Vilardell F, et al. HER2 status in gastric and gastroesophageal junction cancer: results of the large, multinational HER-EAGLE study[J]. Applied Immunohistochemistry & Molecular Morphology, 2018, 26(4): 239-245.
10. QI C, CHONG X, ZHOU T, et al. Clinicopathological significance and immunotherapeutic outcome of claudin 18.2 expression in advanced gastric cancer: a retrospective study[J]. Chin J Cancer Res, 2024, 36(1):78-89.
11. KUBOTA Y, KAWAZOE A, MISHIMA S, et al. Comprehensive clinical and molecular characterization of claudin 18.2 expression in advanced gastric or gastroesophageal junction cancer[J]. ESMO Open, 2023, 8(1):100762.
牛策略-实盘配资开户-在线炒股配资开户-股票配资集中网站提示:文章来自网络,不代表本站观点。